Ⅰ、目的
为规范我院的人类遗传资源管理,特制定本制度。
Ⅱ、范围
1.凡外资(包括独资、合资)企业申报的国际合作项目,涉及采集、 收集、出口、出境等各种人类遗传资源。
2.中国内资企业的临床试验符合下列条件之一:
2.1采集环节涉及特定地区和重要遗传家系。
2.2以保藏为目的的收集活动。
2.3实体样本需要出口、出境。
2.4遗传材料实体样本和(或)有关数据收集交由外资CRO承担的。
3.人类遗传资源指含有人体基因组、基因及其产物的器官、组织、 细胞、核酸、核酸制品等资源材料及其产生的信息资料。
Ⅲ、依据
《药物临床试验质量管理规范》(2020年版)
《中华人民共和国人类遗传资源管理条例》(2019年)
Ⅳ、规程
1.管理规范
1.1 本院不是作为多中心临床试验的组长单位,原则上由申办方委托组长单位主要研究者牵头所有研究中心向国家人类遗传资源管理办公室 提出申请,或委托中心实验室所在地研究中心主要研究者向国家人类遗传资源管理办公室提出申请。
1.2 若申办方与本院为同一省属辖区且本院为牵头单位,本院可牵头省属辖区的其他研究中心向国家人类遗传资源管理办公室提出申请。
1.3 本院作为单独研究中心向国家人类遗传资源管理办公室提出申请。
2.注意事项:申请书要以医院为申请对象,涉及医院内容必须与官网和科室实际情况相吻合,涉及标本类型和数量要以个体受试者为单位描述清楚,各合作方涉及标本工作内容和样本的去向均要描述清楚。人遗获得科技部审批通过后,领取委托函提交机构盖章,并及时把批件递交机构和伦理备案。
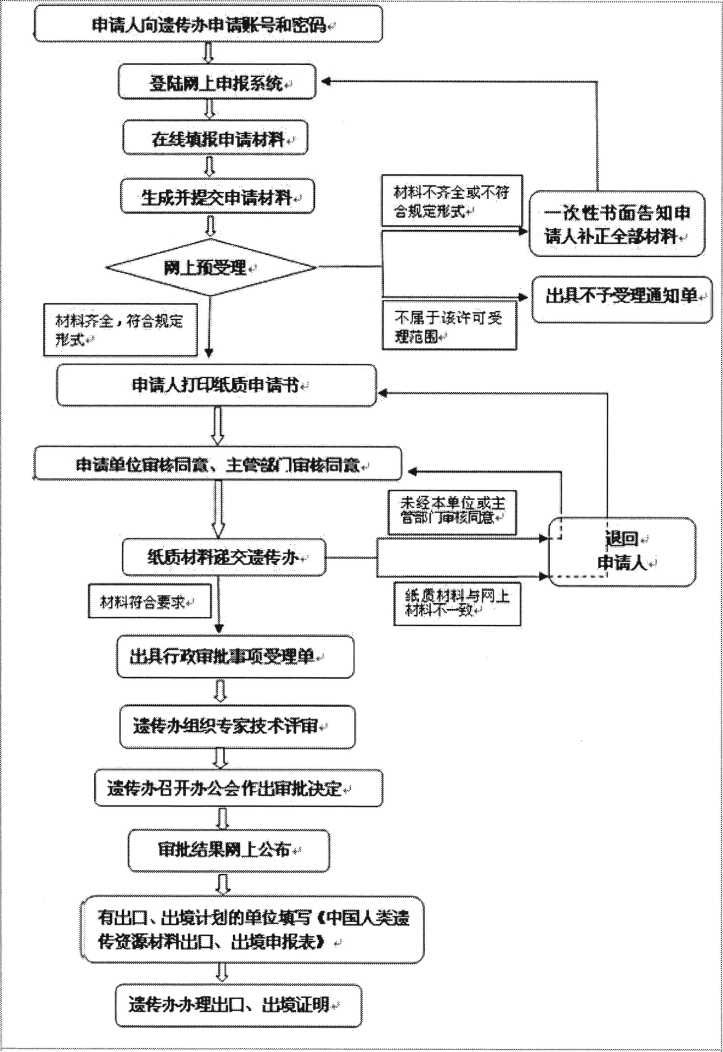
3.过程管理
3.1人类遗传资源办公室批准(网上)后方可开展临床试验并进行标本采集。
在试验中增加人类遗传资源的申报项目需重新上会,经伦理委员会批准后再按上述程序申报,并签补充协议。
3.2对生物样本过程文件进行存档:申办方应根据试验进度定期递交涉及生物样本动向的各类记录单,包括并不限于以下各类表单:生物样本采集单、生物样本离心单、运输单、温控单、交接单、接收回执单或签收其他证明材料、物流公司的资质证书、生物样本销毁记录单等。
3.3对于多中心申报、按总量申报的项目,作为组长单位,项目组要定期汇总分中心的量,计算出总量,避免超量。管理部门要对照批件进行审查。
